Das Newsportal für zahnärztliche Mitteilungen zm-online sowie die Internetseite für medizinische Fachinformationen DocCheck veröffentlichten kürzlich nahezu zeitgleich eine Meldung zu neuesten Studien über Vitamin D in der Onkologie, was die Bedeutung dieses Themas aufzeigt (1,2). Anlass ist die Publikation der Studie einer Kölner Arbeitsgruppe, die den Zusammenhang zwischen einem Vitamin-D-Mangel und der Überlebensrate bei Patienten mit Hodgkin-Lymphom nachweist (3).
Trotz der vorliegenden wissenschaftlichen Daten und zunehmender Evidenz für die herausragende Bedeutung von Vitamin D wird eine routinemäßige Bestimmung des Vitamin-D-Wertes in aktuellen Leitlinien bisher jedoch nicht empfohlen. Auch gibt es noch keine Empfehlung für eine Vitamin-D-Supplementierung. Dies wird damit begründet, dass der tatsächliche Nutzen einer Vitamin-D-Gabe für Patienten bisher nicht nachgewiesen sei. Es wird auf die Notwendigkeit weiterer Studien hingewiesen, um die positiven Einflüsse von Vitamin D auf die Überlebensrate von Krebspatienten zu belegen. Erst dann könne die Bestimmung und die Supplementierung von Vitamin D und auch anderer Vitaminen in die onkologische Routine einbezogen werden (1).
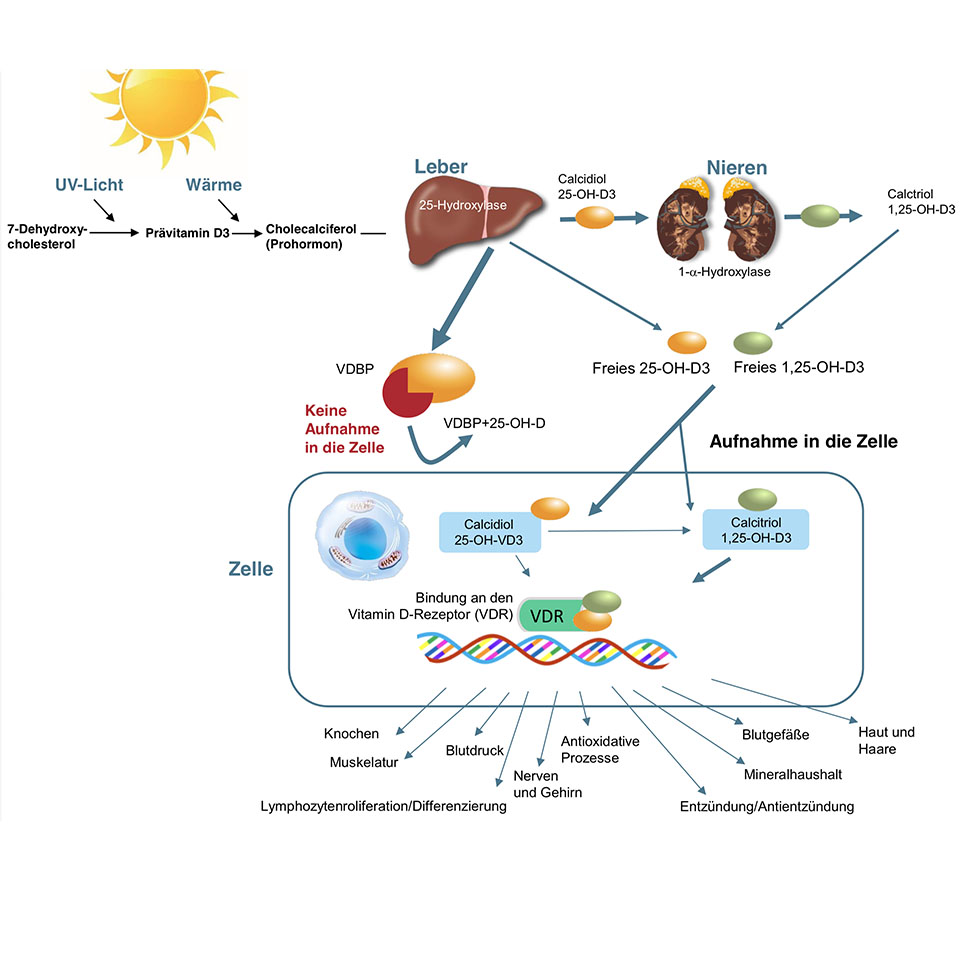
Vitamin D ist mehr als ein Vitamin, es ist die Vorstufe eines fettlöslichen Hormons, das von nahezu allen Körperzellen für eine physiologische Funktion benötigt wird (4–6). Die Produktion des aktiven 1,25-Dihydroxy-Vitamin-D, auch Calcitriol genannt, erfolgt in mehreren Schritten. Ein über die Nahrung aufgenommer Cholesterin-Abkömmling (7-Dehydroxy-Cholesterol) wird unter Einfluss von Sonnenlicht und Wärme in der Haut über die Zwischenstufe Prävitamin D3 zunächst in das Prohormon (Cholecalciferol) umgewandelt. In weiteren Schritten wird daraus in der Leber Calcidiol (25-OH-D3) und schließlich in den Nieren das aktive Calcitriol (1,25-OH-D3). Die Umwandlung in diese aktive Form des Vitamin D wird hormonell reguliert und ist abhängig von der Calcium-Konzentration im Blut. Calcitriol gelangt in die Zelle und bindet dort an den Vitamin-D-Rezeptor, der sich in nahezu allen Körperzellen befindet.
Calcitriol ist verantwortlich für die Regulation der Calcium-Aufnahme, die Aufrechterhaltung eines adäquaten Calciumspiegels im Blut und den Knochenmetabolismus. Es besitzt jedoch noch viele weitere Funktionen und steuert mehr als 2000 Gene (6,7).
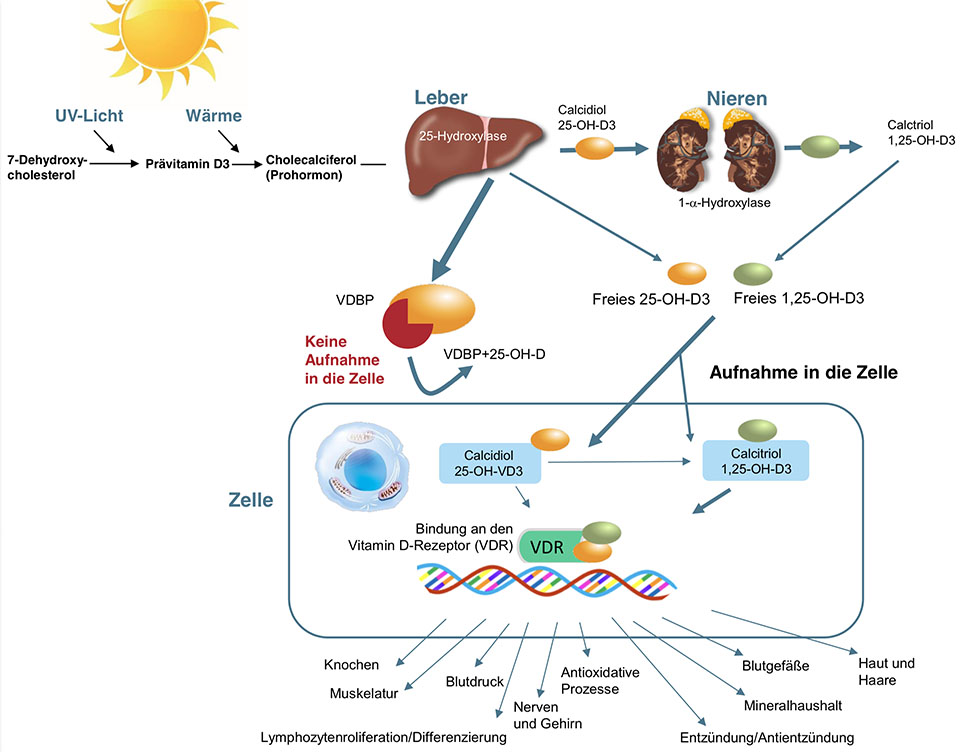
Vitamin D benötigt für seine Funktion weitere Cofaktoren, unter anderem Magnesium, Vitamin K2 und Zink (7). Magnesium wird für die enzymatische Umwandlung zur aktiven Form von Vitamin D3 benötigt (8). Vitamin K2 ist ausschlaggebend für die Verwertung von Calcium und verhindert die Entstehung einer Hyperkalzämie oder Arteriosklerose (9–11). Weitere interessante Aspekte zu Vitamin K2 finden Sie im Newsletter von Dr. Ulrich Volz vom 02.09.2019 mit dem Titel „Vitamin K2/mk7 – ein weiterer Super Hero unter den Vitaminen?“. Zink wird benötigt, da der Vitamin-D-Rezeptor an seiner Basis aus zwei Zink-Molekülen besteht (7,12).
Die Funktionen von Vitamin D sind immens wichtig. Das Vorkommen des Vitamin-D-Rezeptor in nahezu allen Körperzellen verdeutlicht, dass Vitamin D ubiquitär benötigt wird. So veranschaulicht folgende Abbildung, dass ein adäquater Vitamin-D-Spiegel in jedem Lebensalter benötigt wird, vom Embryo bis zum Greis.
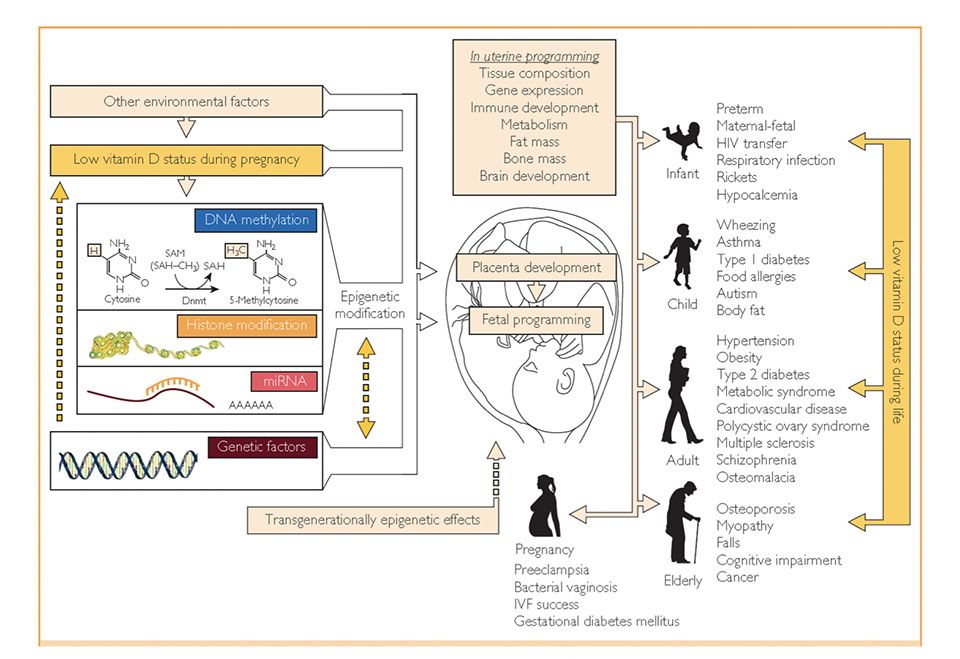
Vitamin D besitzt eine Schlüsselrolle in der Mineral- und Knochenhomöostase (14). Zudem belegen aktuelle Studienergebnisse positive Effekte von Vitamin D in folgenden fünf Funktionsbereichen:
– bei Fertilität/Schwangerschaft (15,16)
– bei Herzkreislauferkrankungen, Diabetes und metabolischem Syndrom (17–20)
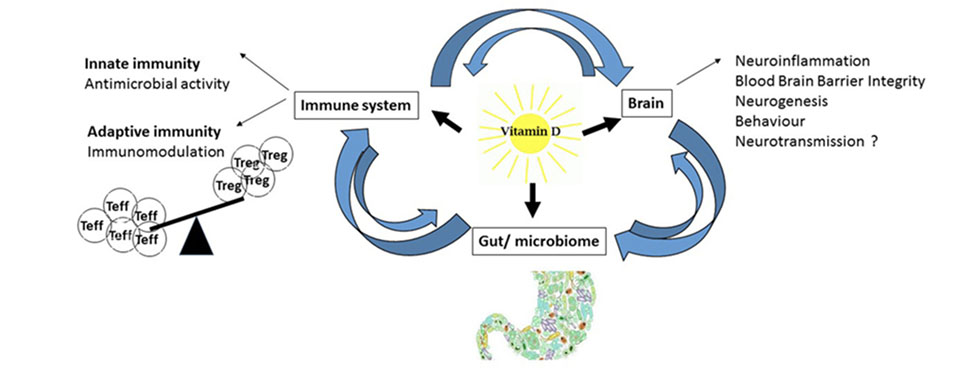
– auf das Immunsystem (21,22)
– auf das Nervensystem (23,24)
– bei Krebserkrankungen (25)
Hierzu gibt es folgende Daten. Schwangeren Frauen wird ein Vitamin-D-Spiegel über 40ng/ml (25-OH-D3) empfohlen, um Mutter und Fötus zu schützen (26). Ein Vitamin-D-Mangel kann Diabetes, Hypertension begünstigen und als kardiovaskulärer Risikofaktor angesehen werden (18). Vitamin D spielt eine tragende Rolle im Immunsystem, moduliert es und schützt vor (viralen) Infektionen und auch vor Autoimmunerkrankungen wie Multipler Sklerose (27–29). Neurologische Erkrankungen wie Schizophrenie oder Autismus sind Vitamin-D-abhängig, auch das Mikrobiom, unser größtes Immunorgan, ist abhängig von Vitamin D (30).
Ganz aktuell sind Meldungen über Vitamin D in der Onkologie, die in vielen Studien untersucht wird. Diese belegen, dass niedrige Vitamin-D-Spiegel bei Patienten mit Kolonkarzinom, Brustkrebs, chronisch lymphatischer Leukämie und akuter myeloischer Leukämie mit einem schlechteren klinischen Outcome und mit einer schlechteren Prognose in Zusammenhang stehen können (31–33). Auch wurde in einer Studie darauf hingewiesen, dass Patienten mit B-Zell-Lymphom durch eine zusätzliche Vitamin-D-Gabe bei der Chemotherapie mit Rituximab profitieren (34). Bei Patienten mit metastasierendem Kolonkarzinom belegte eine Studie, dass ein hoher Vitamin-D-Spiegel das progressionsfreie Überleben verlängert (35). Die eingangs genannte Studie der Kölner Arbeitsgruppe um Dr. Sven Borchmann untersuchte über einen Beobachtungszeitraum von 13 Jahren an 351 Patienten mit Hodgkin-Lymphom, ob ein Vitamin-D-Mangel als Risikofaktor für eine schlechtere Tumorkontrolle angesehen werden kann. Sie konnten tatsächlich zeigen, dass die Patienten mit einem Vitamin-D-Mangel – resultierend aus der schlechteren Tumorkontrolle – ein verringertes progressionsfreies Überleben und Gesamtüberleben aufwiesen (3).
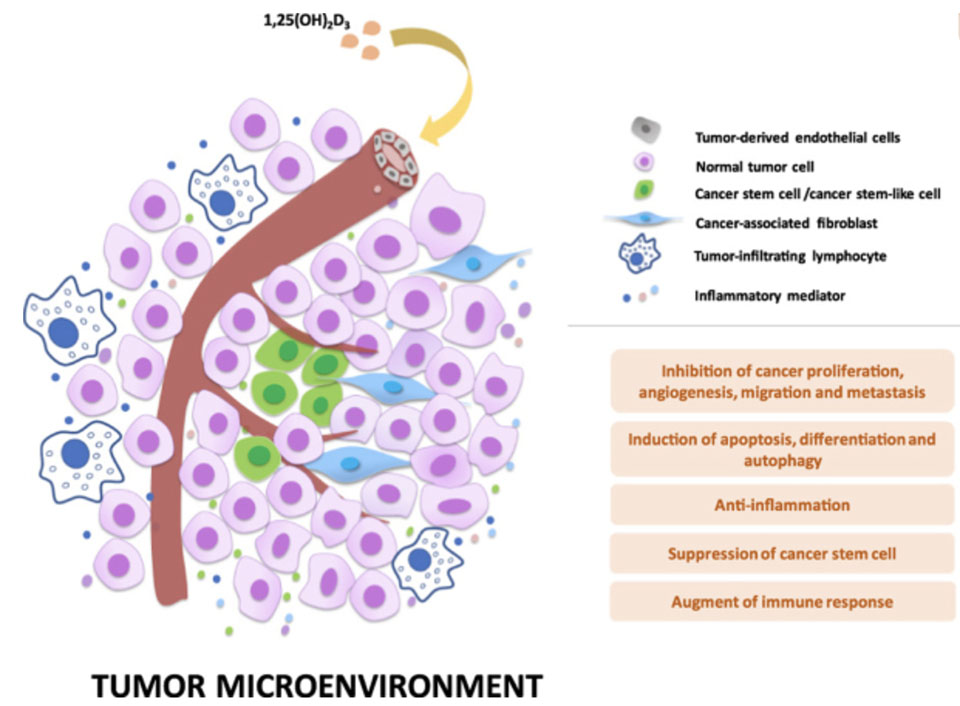
Wu et al. wiesen in ihrer Studie auf eine antikanzerogene Wirkung von Vitamin D hin und empfehlen, es als neuartiges und wirtschaftliches Krebsmittel einzusetzen (36).
Leider liegt heute ein Vitamin-D-Mangel weltweit vor (37).
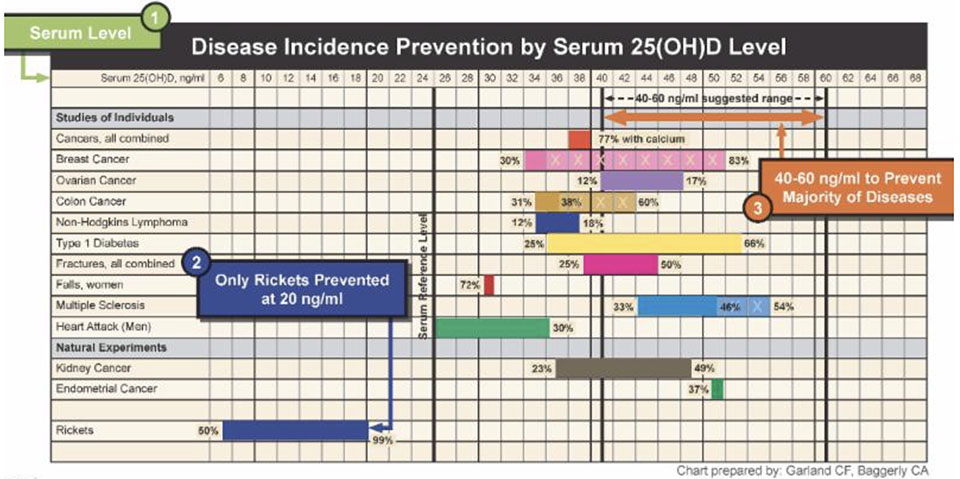
Anschaulich zeigt folgende Abbildung, dass Patienten bei einem Vitamin-D-Wert von 40 – 60ng/ml vor den meisten chronischen Erkrankungen geschützt sind:
Vitamin D in der Zahnheilkunde
Positive Effekte von Vitamin D können in nahezu allen medizinischen Bereichen gefunden werden. Auch in der Zahnmedizin wurde mehrfach die Wichtigkeit von Vitamin D beschrieben. So wurden Zusammenhänge zwischen Vitamin D und Karies, der Molaren-Inzisiven-Hypomineralisation und Gingivitis/Parodontitis belegt (39–44). Vitamin D hemmt das Wachstum und die Expression von Virulenzfaktoren des parodontalen Markerkeims Porphyromonas gingivalis (45); auch wird durch Vitamin D die antibakterielle Aktivität oraler Epithelzellen gegen den parodontalen Keim Aggregatibacter actinomycetem-comitants erhöht (46). Erhöhte Vitamin-D-Werte beeinflussen den lokalen Knochenumbau positiv (47).
Ein Vitamin-D-Mangel dagegen kann die Osseointegration von Implantaten verlangsamen sowie das Risiko für eine Infektion eines Knochentransplantates erhöhen (48–50).
Zusammenfassung
Aus den oben genannten Studien wird ersichtlich, dass die Aufrechterhaltung eines adäquaten Vitamin-D-Spiegels von extremer Wichtigkeit für den menschlichen Organismus ist.
Besonders im Hinblick auf onkologische Krankheitsbilder sind weitere randomisierte klinische Studien erforderlich, um den Nutzen einer Supplementierung mit Vitamin D nachzuweisen und dies in die onkologische Standardtherapie zu integrieren.
Zur Optimierung des Gesundheitszustandes der Patienten und zur Verbesserung der postoperativen Wund- und Knochenheilung ist in der Swiss Biohealth Clinic die Vitamin-D-Supplementierung bereits fest etabliert. Vor operativen Eingriffen wird ein Vitamin-D-Spiegel von zumindest 70 ng/ml angestrebt.
Autorin: Dr. Stephanie Vergote
Mitglied der Swiss Biohealth Academy
References
1. Doccheck. Vitamin D bei Tumoren: Die drei ??? [Internet]. 2019. Available from: https://www.doccheck.com/de/detail/articles/23723-vitamin-d-bei-tumoren-die-drei?utm_source=DC-Newsletter&utm_medium=email&utm_campaign=Newsletter-DE-DocCheck%20News%2019.45%20(Donnerstag)-2019-11-07&utm_content=asset&utm_term=article
2. zm-online. Hodgkin Lymphom: Vitamin-D-Mangel verschlechtert Überleben [Internet]. 2019. Available from: https://www.zm-online.de/news/gesellschaft/hodgkin-lymphom-vitamin-d-mangel-verschlechtert-ueberleben
3. Borchmann S, Cirillo M, Goergen H, Meder L, Sasse S, Kreissl S, Bröckelmann PJ, Tresckow B v., Fuchs M, Ullrich RT, Engert A. Pretreatment Vitamin D Deficiency Is Associated With Impaired Progression-Free and Overall Survival in Hodgkin Lymphoma. Journal of Clinical Oncology. 2019;JCO.19.00985. doi:10.1200/JCO.19.00985
4. DeLuca HF. Overview of general physiologic features and functions of vitamin D. Am J Clin Nutr. 2004;80(6 Suppl):1689S-96S. doi:10.1093/ajcn/80.6.1689S
5. Bikle D. Nonclassic Actions of Vitamin D. J Clin Endocrinol Metab. 2008;94(1):26–34. doi:10.1210/jc.2008-1454
6. Zittermann A, Gummert JF. Nonclassical vitamin D action. Nutrients. 2010;2(4):408–25. doi:10.3390/nu2040408
7. Schweihart Vitamin D – das Sonnenhormon. Vitamin D Stoffwechsel [Internet]. Available from: https://www.vitamind.net/vitamin-d3/stoffwechsel/
8. Zittermann A. Magnesium deficit ? overlooked cause of low vitamin D status? BMC Med. 2013;11229. doi:10.1186/1741-7015-11-229
9. Masterjohn C. Vitamin D toxicity redefined: vitamin K and the molecular mechanism. Med Hypotheses. 2007;68(5):1026–34. doi:10.1016/j.mehy.2006.09.051
10. Schurgers LJ, Cranenburg ECM, Vermeer C. Matrix Gla-protein: the calcification inhibitor in need of vitamin K. Thromb Haemost. 2008;100(4):593–603.
11. Flore R, Ponziani FR, Di Rienzo TA, Zocco MA, Flex A, Gerardino L, Lupascu A, Santoro L, Santoliquido A, Di Stasio E, Chierici E, Lanti A, Tondi P, Gasbarrini A. Something more to say about calcium homeostasis: the role of vitamin K2 in vascular calcification and osteoporosis. Eur Rev Med Pharmacol Sci. 2013;17(18):2433–40.
12. Freedman LP, Towers TL. DNA Binding Properties of the Vitamin D3 Receptor Zinc Finger Region: Cell Biology and Genetics Program Sloan-Kettering Institute New York, New York 10021. Molecular Endocrinology. 1991.
13. Holick. Vitamin D, placenta development, fetal programming, and epigenetic modification. A— adenosine; CH3 — methylgroup; HIV — human immunodeficiency virus; IVF — in vitro fertilization; miRNA, micro RNA; SAH — S-adenosylhomocysteine; SAM— single carbon from adenosylmethionine [Internet]. 2013. Available from: https://vitamindwiki.com/Vitamin+D+Global+Perspective+-+Holick+June+2013
14. Sawatsubashi S. Bone and Nutrition. The vitamin D functions in osteoblasts and osteocytes. Clin Calcium. 2015;25(7):991–7. jpn.
15. Hollis BW, Wagner CL. Vitamin D supplementation during pregnancy: Improvements in birth outcomes and complications through direct genomic alteration. Mol Cell Endocrinol. 2017;453113–30. doi:10.1016/j.mce.2017.01.039
16. Voulgaris N, Papanastasiou L, Piaditis G, Angelousi A, Kaltsas G, Mastorakos G, Kassi E. Vitamin D and aspects of female fertility. Hormones (Athens). 2017;16(1):5–21. doi:10.14310/horm.2002.1715
17. Al Mheid I, Patel R, Murrow J, Morris A, Rahman A, Fike L, Kavtaradze N, Uphoff I, Hooper C, Tangpricha V, Alexander RW, Brigham K, Quyyumi AA. Vitamin D status is associated with arterial stiffness and vascular dysfunction in healthy humans. J Am Coll Cardiol. 2011;58(2):186–92. doi:10.1016/j.jacc.2011.02.051
18. Anderson JL, May HT, Horne BD, Bair TL, Hall NL, Carlquist JF, Lappé DL, Muhlestein JB. Relation of vitamin D deficiency to cardiovascular risk factors, disease status, and incident events in a general healthcare population. Am J Cardiol. 2010;106(7):963–8. doi:10.1016/j.amjcard.2010.05.027
19. Dimova R, Tankova T, Chakarova N. Vitamin D in the Spectrum of Prediabetes and Cardiovascular Autonomic Dysfunction. J Nutr. 2017;147(9):1607–15. doi:10.3945/jn.117.250209
20. Szep Z, Guaraldi G, Shah SS, Lo Re V, Ratcliffe SJ, Orlando G, Carli F, Rossi R, Rochira V, Tebas P. Vitamin D deficiency is associated with type 2 diabetes mellitus in HIV infection. AIDS. 2011;25(4):525–9. doi:10.1097/QAD.0b013e328342fdfd
21. Kamen DL, Tangpricha V. Vitamin D and molecular actions on the immune system: modulation of innate and autoimmunity. J Mol Med. 2010;88(5):441–50. doi:10.1007/s00109-010-0590-9
22. Cantorna MT, Zhao J, Yang L. Vitamin D, invariant natural killer T-cells and experimental autoimmune disease. Proc Nutr Soc. 2012;71(1):62–6. doi:10.1017/S0029665111003193
23. Wrzosek M, Łukaszkiewicz J, Wrzosek M, Jakubczyk A, Matsumoto H, Piątkiewicz P, Radziwoń-Zaleska M, Wojnar M, Nowicka G. Vitamin D and the central nervous system. Pharmacol Rep. 2013;65(2):271–8. doi:10.1016/s1734-1140(13)71003-x
24. Holmøy T, Moen SM. Assessing vitamin D in the central nervous system. Acta Neurol Scand , Suppl. 2010;(190):88–92. doi:10.1111/j.1600-0404.2010.01383.x
25. Holick MF. Vitamin D: A millenium perspective. J Cell Biochem. 2003;88(2):296–307. doi:10.1002/jcb.10338
26. Wagner CL, Hollis BW. The Implications of Vitamin D Status During Pregnancy on Mother and her Developing Child. Front Endocrinol (Lausanne). 2018;9500. doi:10.3389/fendo.2018.00500
27. Gombart AF. The vitamin D-antimicrobial peptide pathway and its role in protection against infection. Future Microbiol. 2009;4(9):1151–65. doi:10.2217/fmb.09.87
28. Berry DJ, Hesketh K, Power C, Hyppönen E. Vitamin D status has a linear association with seasonal infections and lung function in British adults. Br J Nutr. 2011;106(9):1433–40. doi:10.1017/S0007114511001991
29. Cantorna MT, Mahon BD. Mounting evidence for vitamin D as an environmental factor affecting autoimmune disease prevalence. Exp Biol Med (Maywood). 2004;229(11):1136–42. doi:10.1177/153537020422901108
30. Kočovská E, Gaughran F, Krivoy A, Meier U-C. Vitamin-D Deficiency As a Potential Environmental Risk Factor in Multiple Sclerosis, Schizophrenia, and Autism. Front Psychiatry. 2017;847. doi:10.3389/fpsyt.2017.00047
31. Maalmi H, Ordóñez-Mena JM, Schöttker B, Brenner H. Serum 25-hydroxyvitamin D levels and survival in colorectal and breast cancer patients: systematic review and meta-analysis of prospective cohort studies. Eur J Cancer. 2014;50(8):1510–21. doi:10.1016/j.ejca.2014.02.006
32. Shanafelt TD, Drake MT, Maurer MJ, Allmer C, Rabe KG, Slager SL, Weiner GJ, Call TG, Link BK, Zent CS, Kay NE, Hanson CA, Witzig TE, Cerhan JR. Vitamin D insufficiency and prognosis in chronic lymphocytic leukemia. Blood. 2011;117(5):1492–8. doi:10.1182/blood-2010-07-295683
33. Lee HJ, Muindi JR, Tan W, Hu Q, Wang D, Liu S, Wilding GE, Ford LA, Sait SNJ, Block AW, Adjei AA, Barcos M, Griffiths EA, Thompson JE, Wang ES, Johnson CS, Trump DL, Wetzler M. Low 25(OH) vitamin D3 levels are associated with adverse outcome in newly diagnosed, intensively treated adult acute myeloid leukemia. Cancer. 2014;120(4):521–9. doi:10.1002/cncr.28368
34. Bittenbring JT, Neumann F, Altmann B, Achenbach M, Reichrath J, Ziepert M, Geisel J, Regitz E, Held G, Pfreundschuh M. Vitamin D deficiency impairs rituximab-mediated cellular cytotoxicity and outcome of patients with diffuse large B-cell lymphoma treated with but not without rituximab. J Clin Oncol. 2014;32(29):3242–8. doi:10.1200/JCO.2013.53.4537
35. Ng K, Nimeiri HS, McCleary NJ, Abrams TA, Yurgelun MB, Cleary JM, Rubinson DA, Schrag D, Miksad R, Bullock AJ, Allen J, Zuckerman D, Chan E, Chan JA, Wolpin BM, Constantine M, Weckstein DJ, Faggen MA, Thomas CA, Kournioti C, Yuan C, Ganser C, Wilkinson B, Mackintosh C, Zheng H, Hollis BW, Meyerhardt JA, Fuchs CS. Effect of High-Dose vs Standard-Dose Vitamin D3 Supplementation on Progression-Free Survival Among Patients With Advanced or Metastatic Colorectal Cancer: The SUNSHINE Randomized Clinical Trial. JAMA. 2019;321(14):1370–9. doi:10.1001/jama.2019.2402
36. Wu X, Hu W, Lu L, Zhao Y, Zhou Y, Xiao Z, Zhang L, Zhang H, Li X, Li W, Wang S, Cho CH, Shen J, Li M. Repurposing vitamin D for treatment of human malignancies via targeting tumor microenvironment. Acta Pharm Sin B. 2019;9(2):203–19. doi:10.1016/j.apsb.2018.09.002
37. van Schoor N, Lips P. Global Overview of Vitamin D Status. Endocrinol Metab Clin North Am. 2017;46(4):845–70. doi:10.1016/j.ecl.2017.07.002
38. Garland CF BCA. Disease Incidence Prevention by Serum 25(OH)D Level [Internet]. Available from: http://files.ctctcdn.com/25aa06fb001/cc1fc56c-f98d-42b3-98d1-d6e2f1cd4a65.jpg
39. Kim I-J, Lee H-S, Ju H-J, Na J-Y, Oh H-W. A cross-sectional study on the association between vitamin D levels and caries in the permanent dentition of Korean children. BMC Oral Health. 2018;18(1):43. doi:10.1186/s12903-018-0505-7
40. Schroth RJ, Rabbani R, Loewen G, Moffatt ME. Vitamin D and Dental Caries in Children. J Dent Res. 2016;95(2):173–9. doi:10.1177/0022034515616335
41. Kühnisch J, Thiering E, Kratzsch J, Heinrich-Weltzien R, Hickel R, Heinrich J. Elevated serum 25(OH)-vitamin D levels are negatively correlated with molar-incisor hypomineralization. J Dent Res. 2015;94(2):381–7. doi:10.1177/0022034514561657
42. Bhargava A, Rastogi P, Lal N, Singhal R, Khatoon S, Ali Mahdi A. Relationship between VITAMIN D and chronic periodontitis. J Oral Biol Craniofac Res. 2019;9(2):177–9. doi:10.1016/j.jobcr.2018.07.001
43. Meghil MM, Hutchens L, Raed A, Multani NA, Rajendran M, Zhu H, Looney S, Elashiry M, Arce RM, Peacock ME, Dong Y, Cutler CW. The influence of vitamin D supplementation on local and systemic inflammatory markers in periodontitis patients: A pilot study. Oral Dis. 2019;25(5):1403–13. doi:10.1111/odi.13097
44. Nørrisgaard PE, Haubek D, Kühnisch J, Chawes BL, Stokholm J, Bønnelykke K, Bisgaard H. Association of High-Dose Vitamin D Supplementation During Pregnancy With the Risk of Enamel Defects in Offspring: A 6-Year Follow-up of a Randomized Clinical Trial. JAMA Pediatr. 2019. doi:10.1001/jamapediatrics.2019.2545
45. Grenier D, Morin M-P, Fournier-Larente J, Chen H. Vitamin D inhibits the growth of and virulence factor gene expression by Porphyromonas gingivalis and blocks activation of the nuclear factor kappa B transcription factor in monocytes. J Periodont Res. 2016;51(3):359–65. doi:10.1111/jre.12315
46. McMahon L, Schwartz K, Yilmaz O, Brown E, Ryan LK, Diamond G. Vitamin D-mediated induction of innate immunity in gingival epithelial cells. Infect Immun. 2011;79(6):2250–6. doi:10.1128/IAI.00099-11
47. Schulze-Späte U, Dietrich T, Wu C, Wang K, Hasturk H, Dibart S. Systemic vitamin D supplementation and local bone formation after maxillary sinus augmentation – a randomized, double-blind, placebo-controlled clinical investigation. Clin Oral Implants Res. 2016;27(6):701–6. doi:10.1111/clr.12641
48. Choukroun J, Khoury G, Khoury F, Russe P, Testori T, Komiyama Y, Sammartino G, Palacci P, Tunali M, Choukroun E. Two neglected biologic risk factors in bone grafting and implantology: high low-density lipoprotein cholesterol and low serum vitamin D. J Oral Implantol. 2014;40(1):110–4. doi:10.1563/AAID-JOI-D-13-00062
49. Bryce G, MacBeth N. Vitamin D deficiency as a suspected causative factor in the failure of an immediately placed dental implant: a case report. J R Nav Med Serv. 2014;100(3):328–32.
50. Cooper LF. Systemic effectors of alveolar bone mass and implications in dental therapy. Periodontol 2000. 2000;23103–9. doi:10.1034/j.1600-0757.2000.2230110.x